Étude Thermodynamique
Modélisation du profil de température
💎 PROTOCOLE "RESPONSIVE-TABLES-RESTORE" 💎 MODIFICATIONS : 1. CSS : Suppression définitive de 'min-width' sur .tbl et .report-table. 2. CSS : Suppression de 'white-space: nowrap' sur les en-têtes (.tbl th). 3. HTML : Ajout du wrapper .mic-table-scroll autour du tableau...
Étude de l’effet Thomson
Exercice TPI : Effet Thomson BOÎTE À OUTILS 📝 Quiz Rapide 🧮 Calculatrice 📏 Normes & Standards 📚 Glossaire 💡 LE SAVIEZ-VOUS ? Chargement d'une anecdote... Titre Outil × À DÉCOUVRIR SUR LE SITE Production d'entropie dans une résistance Analyse de l'irréversibilité par...
Production d’entropie dans une résistance électrique
Exercice TPI : Production d'Entropie BOÎTE À OUTILS 📝 Quiz Rapide 🧮 Calculatrice 📏 Normes & Standards 📚 Glossaire 💡 LE SAVIEZ-VOUS ? Chargement d'une anecdote... Titre Outil × À DÉCOUVRIR SUR LE SITE Diffusion à travers une membrane poreuse Analyse des flux de matière...


FAQ - Thermodynamique
Explorez les principes fondamentaux de la thermodynamique.
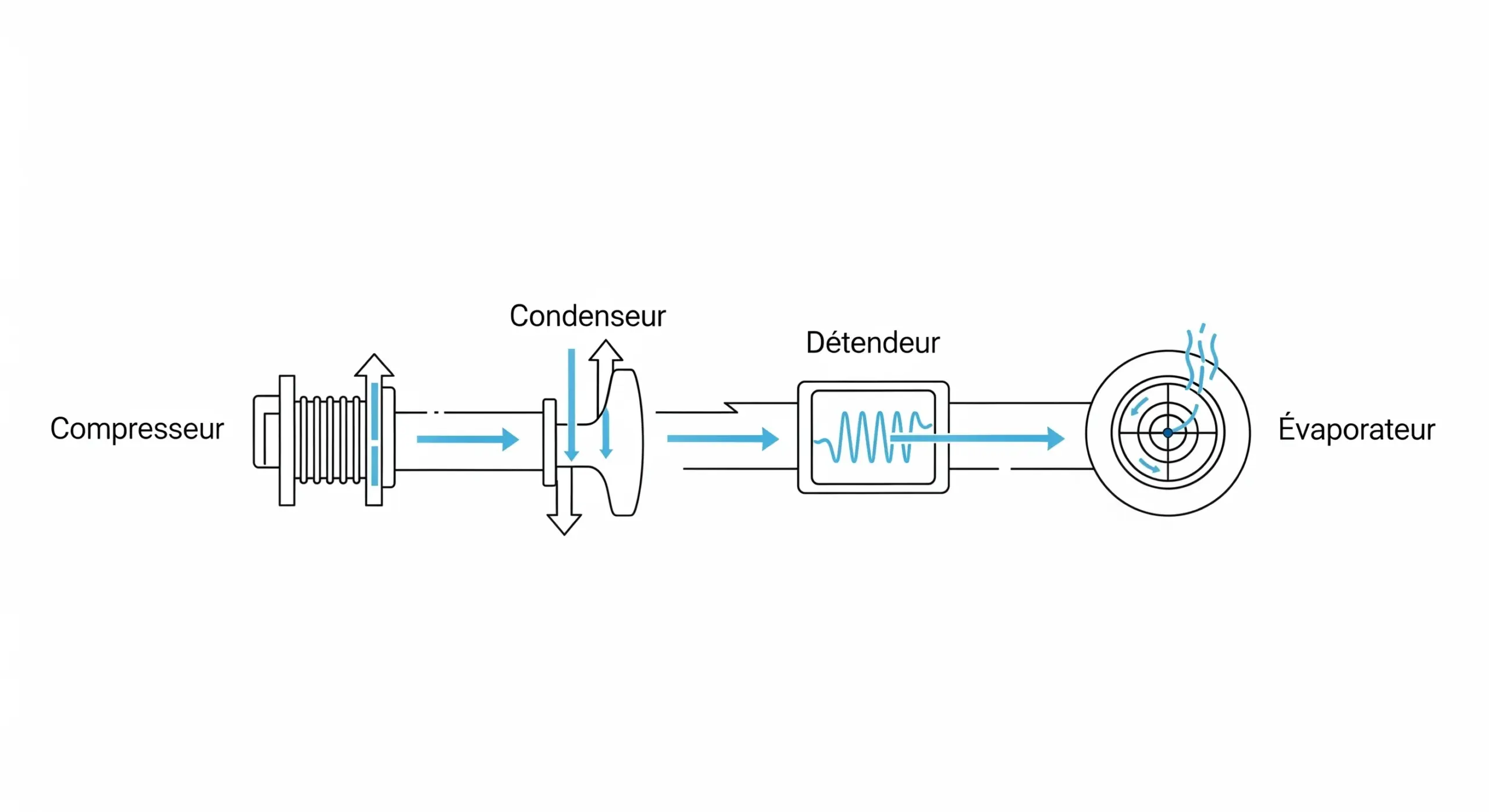
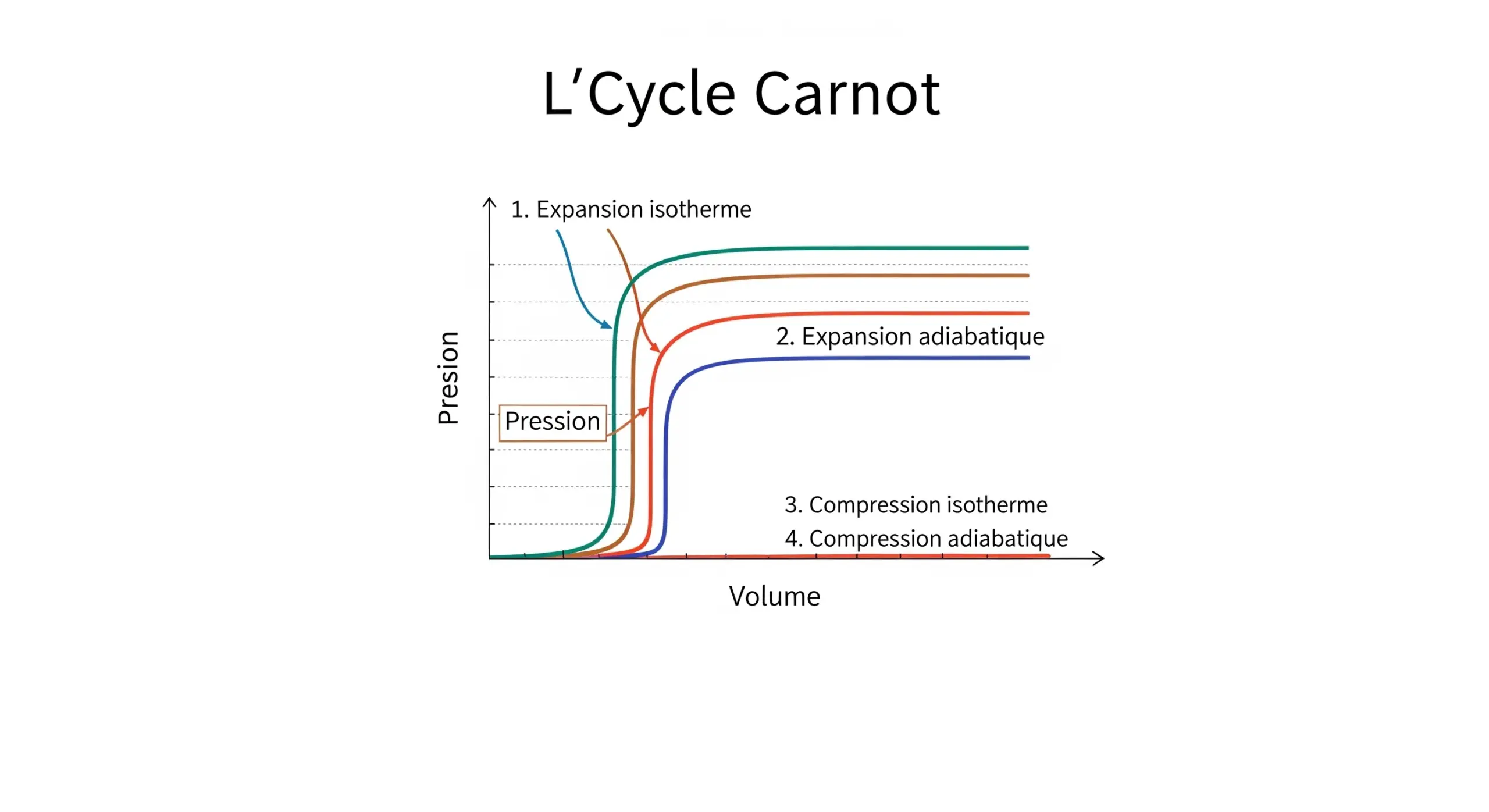
La thermodynamique est la branche de la physique qui étudie les relations entre la chaleur, le travail et l'énergie. Elle décrit comment l'énergie thermique est convertie en d'autres formes d'énergie et comment elle affecte la matière. Ses principes sont essentiels pour comprendre les moteurs, les réfrigérateurs, les réactions chimiques et même les phénomènes cosmiques.
Il y a quatre lois fondamentales :
• Principe Zéro : Si deux systèmes sont en équilibre thermique avec un troisième, ils sont en équilibre thermique entre eux. Cela définit la notion de température.
• Première Loi : L'énergie ne peut être ni créée ni détruite, seulement transformée (principe de conservation de l'énergie).
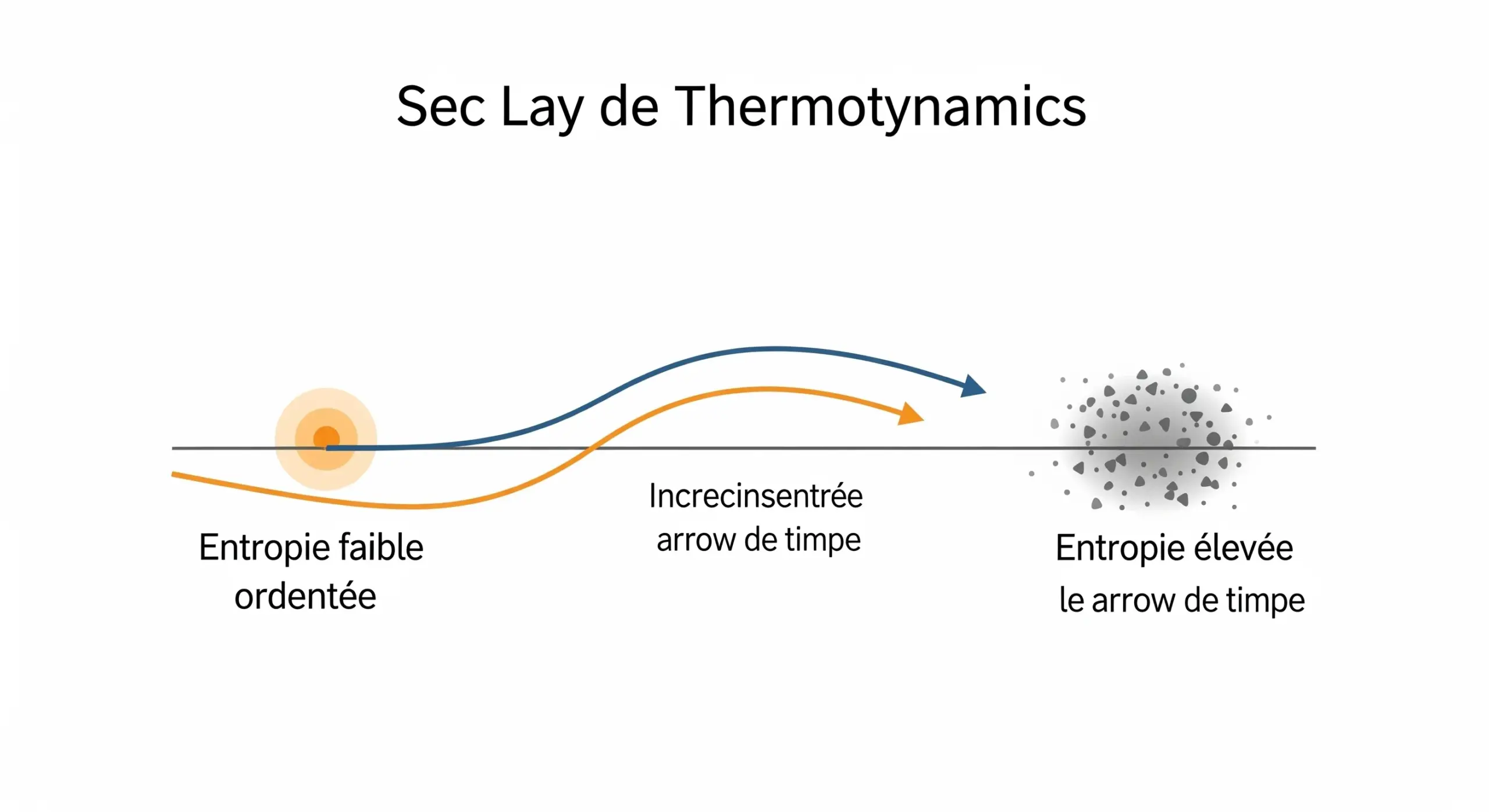
• Deuxième Loi : L'entropie (le désordre) d'un système isolé ne peut qu'augmenter. Cela explique pourquoi la chaleur s'écoule du chaud vers le froid.
• Troisième Loi : L'entropie d'un système s'approche d'une valeur constante lorsque la température s'approche du zéro absolu.
La température est une mesure de l'agitation moyenne des particules (atomes ou molécules) dans un système. C'est une mesure de l'énergie cinétique moyenne. La chaleur, quant à elle, est le transfert d'énergie thermique entre deux systèmes en raison d'une différence de température. On peut voir la température comme un état, et la chaleur comme un flux d'énergie.
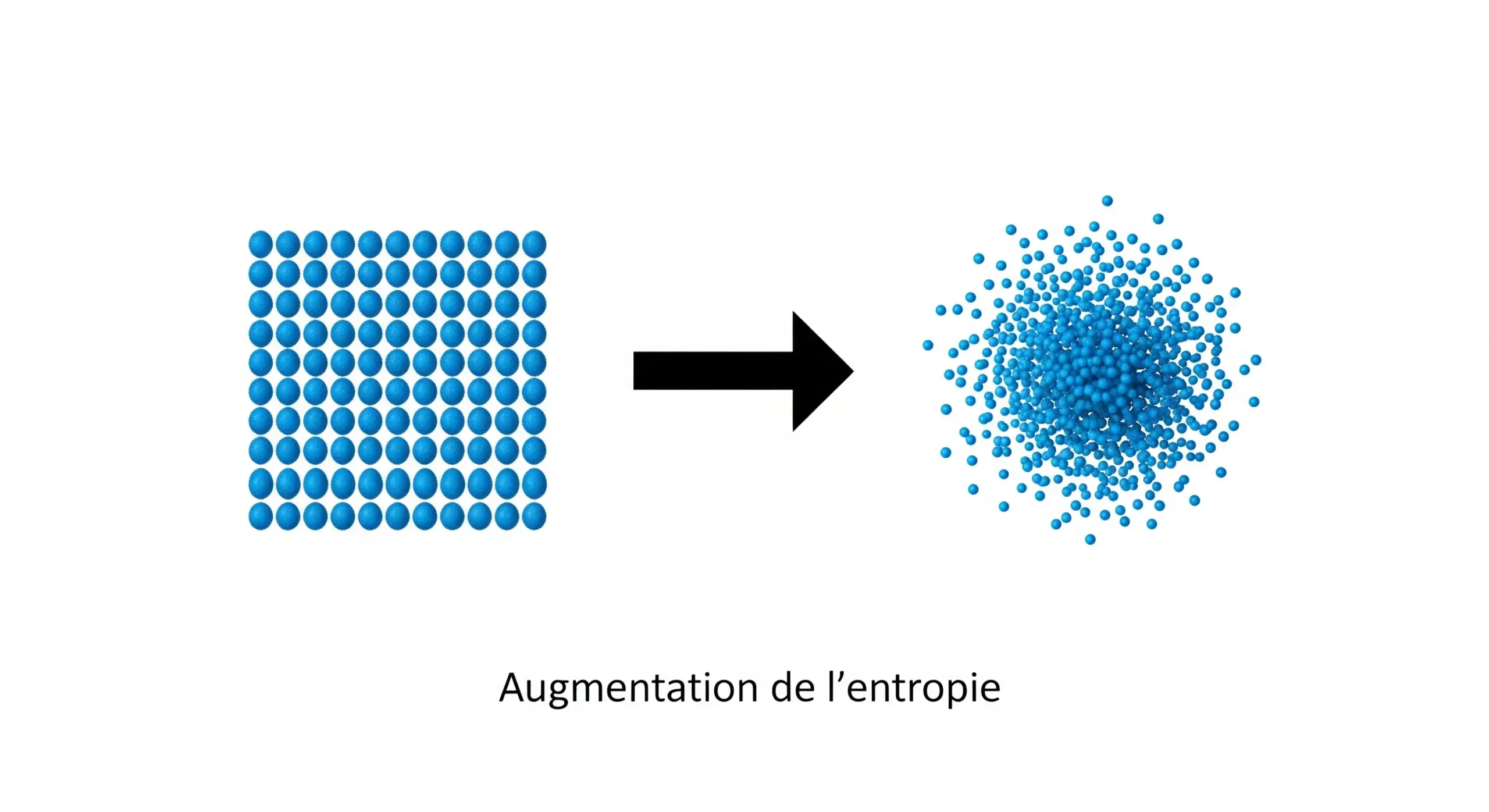
L'entropie est une mesure du désordre ou de l'incertitude dans un système. Selon la deuxième loi de la thermodynamique, l'univers tend naturellement vers un état de plus grand désordre. Par exemple, un glaçon (état ordonné) qui fond dans un verre d'eau (état plus désordonné) est une augmentation de l'entropie. C'est une concept fondamental qui explique la "flèche du temps" et pourquoi certains processus sont irréversibles.
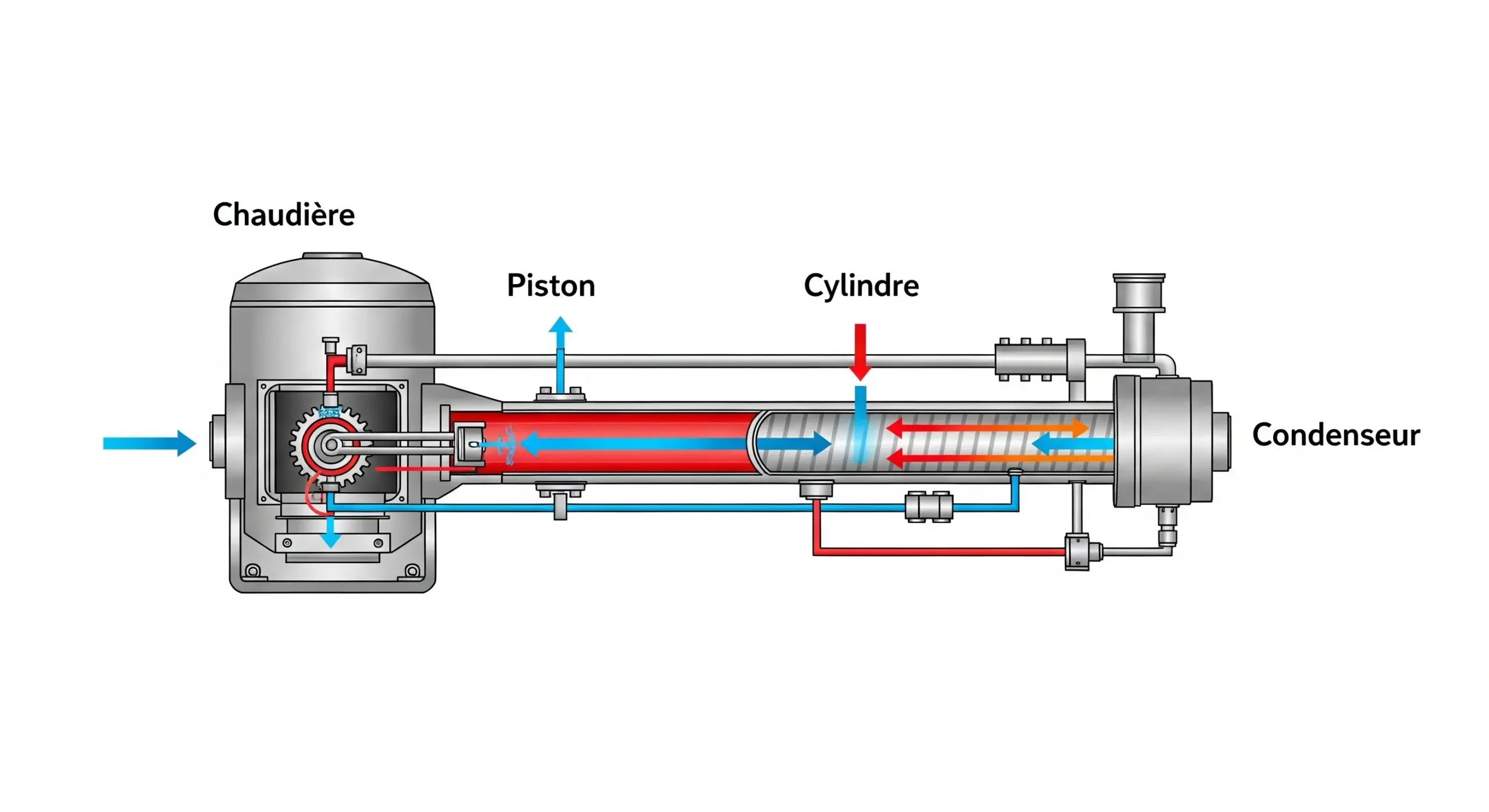
Simulateur de Moteur Thermique
Ajoutez de la chaleur pour voir l'effet sur les particules de gaz et le piston.

A propos de nous
Pendant nos études, on s’est rapidement rendu compte qu’il était difficile de trouver des exercices sur chaque domaine de thermodynamique donc il fallait que nous reglons ce probleme afin d’améliorer la compréhension de chaque cours de thermodynamique d’où la naissance d’étude thermodynamique.
Étude thermodynamique
Thermodynamique Classique
Thermodynamique Statistique
Thermodynamique Chimique
Nos exercices
Modélisation du profil de température
💎 PROTOCOLE "RESPONSIVE-TABLES-RESTORE" 💎 MODIFICATIONS : 1. CSS : Suppression définitive de 'min-width' sur .tbl et .report-table. 2. CSS : Suppression de 'white-space: nowrap' sur les en-têtes (.tbl th). 3. HTML : Ajout du wrapper .mic-table-scroll autour du tableau...
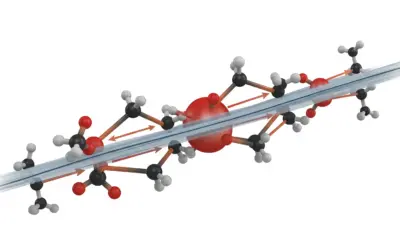
Étude de l’effet Thomson
Exercice TPI : Effet Thomson BOÎTE À OUTILS 📝 Quiz Rapide 🧮 Calculatrice 📏 Normes & Standards 📚 Glossaire 💡 LE SAVIEZ-VOUS ? Chargement d'une anecdote... Titre Outil × À DÉCOUVRIR SUR LE SITE Production d'entropie dans une résistance Analyse de l'irréversibilité par...
Production d’entropie dans une résistance électrique
Exercice TPI : Production d'Entropie BOÎTE À OUTILS 📝 Quiz Rapide 🧮 Calculatrice 📏 Normes & Standards 📚 Glossaire 💡 LE SAVIEZ-VOUS ? Chargement d'une anecdote... Titre Outil × À DÉCOUVRIR SUR LE SITE Diffusion à travers une membrane poreuse Analyse des flux de matière...
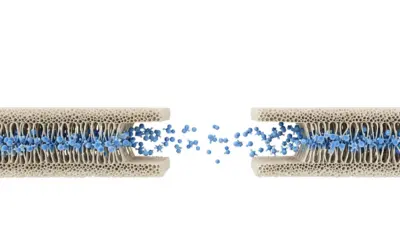
Diffusion d’une espèce à travers une membrane poreuse
Exercice TPI : Diffusion Membranaire BOÎTE À OUTILS 📝 Quiz Rapide 🧮 Calculatrice 📏 Normes & Standards 📚 Glossaire Titre Outil × À DÉCOUVRIR SUR LE SITE Calcul de la Conductivité Thermique Détermination pour un gaz. Relations d'Onsager Symétrie des coefficients...
Calcul de la conductivité thermique d’un gaz
Calcul de la conductivité thermique (TPI) BOÎTE À OUTILS 📝 Quiz Rapide 🧮 Calculatrice 📏 Normes & Standards 📚 Glossaire Titre Outil × À DÉCOUVRIR SUR LE SITE Relations de réciprocité d'Onsager Les fondements de la TPI. Production d'entropie (Expansion libre)...
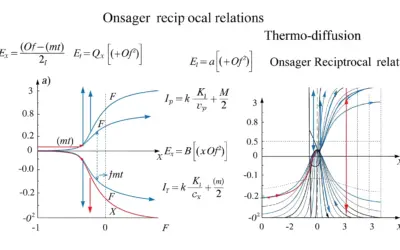
Relations de réciprocité d’Onsager
Relations d'Onsager - Thermodynamique Approfondie BOÎTE À OUTILS 📝 Quiz Rapide 🧮 Calculatrice 📏 Normes & Standards 📚 Glossaire Titre Outil × À DÉCOUVRIR SUR LE SITE Production d'entropie : Expansion libre Étude de l'irréversibilité lors de la détente d'un gaz....
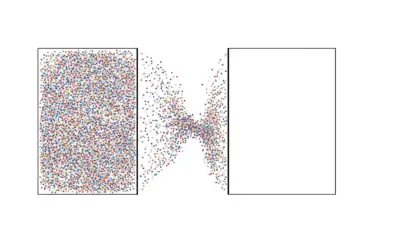
Production d’entropie lors de l’expansion libre d’un gaz
Exercice : Production d'Entropie - Expansion Libre BOÎTE À OUTILS 📝 Quiz Rapide 🧮 Calculatrice 📏 Normes & Standards 📚 Glossaire Titre Outil × À DÉCOUVRIR SUR LE SITE Analyse de l'effet Peltier Comprendre le refroidissement thermoélectrique. Force...
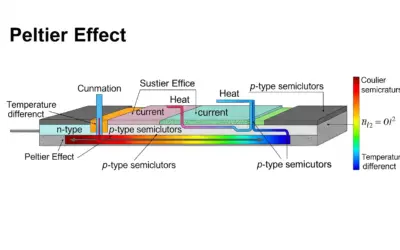
Analyse de l’effet Peltier
Exercice : Thermodynamique du Module Peltier BOÎTE À OUTILS 📝 Quiz Rapide 🧮 Calculatrice 📏 Normes & Standards 📚 Glossaire Titre Outil × À DÉCOUVRIR SUR LE SITE Force Thermoélectromotrice d'un Thermocouple Comprendre l'origine du signal dans les capteurs de...
Glossaire de la Thermodynamique
Comprenez les lois de l'énergie, de la chaleur et du désordre.
Index des Termes
Sélectionnez un terme
Cliquez sur un mot dans l'index pour afficher sa définition détaillée ici.